Redoxní reakce
Fe⁰ + Cuᴵᴵ(SO₄)⁻ᴵᴵ Cu⁰ + Feᴵᴵ(SO₄)⁻ᴵᴵ
- oxidace, redukce
- během reakce proběhly 2 rovnocenné děje - oxidace a redukce
Informace
- redoxní - redukce (snižování oxidačního čísla, elektrony přicházejí), oxidace (zvyšování oxidačního čísla, elektrony odcházejí)
- při této reakci dochází ke změně oxidačních čísel atomů prvků
- při redoxních reakcí dochází k výměně e⁻
- výměnu můžeme zapsat iontovou rovnicí reakce
- reakce se skládá ze 2 poloreakcí
Redukční činidlo - látka obsahující atomy, které se při reakce oxidují (oxidační číslo atomu se zvětšuje) Oxidační činidlo - látka obsahující atomy, které se při reakce redukují (oxidační číslo atomu se zmenšuje)
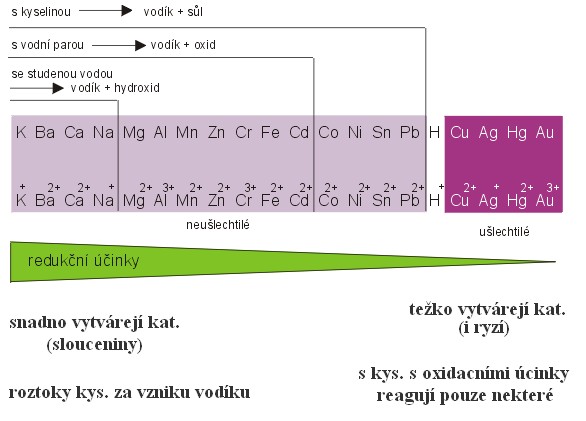
Redoxní vlastnosti kovů a nekovů
- zinek vytěsnil měď z její soli (síranu měďnatého) - CuSO₄ + Zn Cu + ZnSO₄
- zinek vytěsnil stříbro z její soli (dusičnanu stříbrného) - 2AgNO₃ + Cu 2Ag + Cu(NO₃)₂
- zinek vytěsňuje z roztoků solí měď i stříbro, měď vytěsňuje jen stříbro (Ze > Cu > Ag)
Zdroj obrázku: zapisky4.webnode.cz
Řada začíná nejvíce reaktivními kovy (alkalické kovy a kovy alkalických zemin) a konší nejméně reaktivními kovy. Reaktivní kovy se slučují s ostatními prvky, proto se v přírodě vyskytují jen ve sloučeninách. Naopak nereaktivní prvky najdeme v přírodě. volné = ryzí (zlato, stříbro, rtuť atd.)
Kovy nalevo od vodíku se označují jako neušlechtilé. Kovy napravo jako ušlechtilé
Hoření síry
S⁰ + O₂⁰ Sᴵⱽ + O₂⁻ᴵᴵ
mezi redoxní reakce patří i hoření
oxidační číslo atomu síry se zvětšilo, proběhla oxidace síry
oxidační číslo atomu kyslíku se zmenšilo, proběhla redukce kyslík
elektrony, které oxidovaná částice ztrácí, přijímá redukovaná částice
oxidovaná částice
- S - 4 e⁻ S⁴⁺
- S⁰ Sᴵⱽ
redukovaná částice
- O₂ + 4 e⁻ S²⁻
- O₂⁰ 2 O⁻ᴵᴵ
hoření
- exotermická reakce, při které vzniká teplo a světlo
- často je doprovázeno vznikem plamene
- aby mohlo k hoření dojít, musí být splněny podmínky:
- přítomnost hořlavé látky
- přítomnost oxidačního činidla (vzdušný kyslík)
- dosažení teploty hoření (zápalné teploty)
teplota hoření - nejnižší teplota, při které látka po zapálení trvale hoří
teplota vzplanutí - nejnižší teplota, při které látka po přiblížení plamene na krátký okamžik vzplane, pak ale opět uhasne
hořlavé látky (hořlaviny) - látky tuhého, kapalného nebo plynného skupenství, které jsou schopny uvolňovat při pořáru teplo
hačící přístroje - ochlazují hořící látky a zamezují přístupu vzduchu
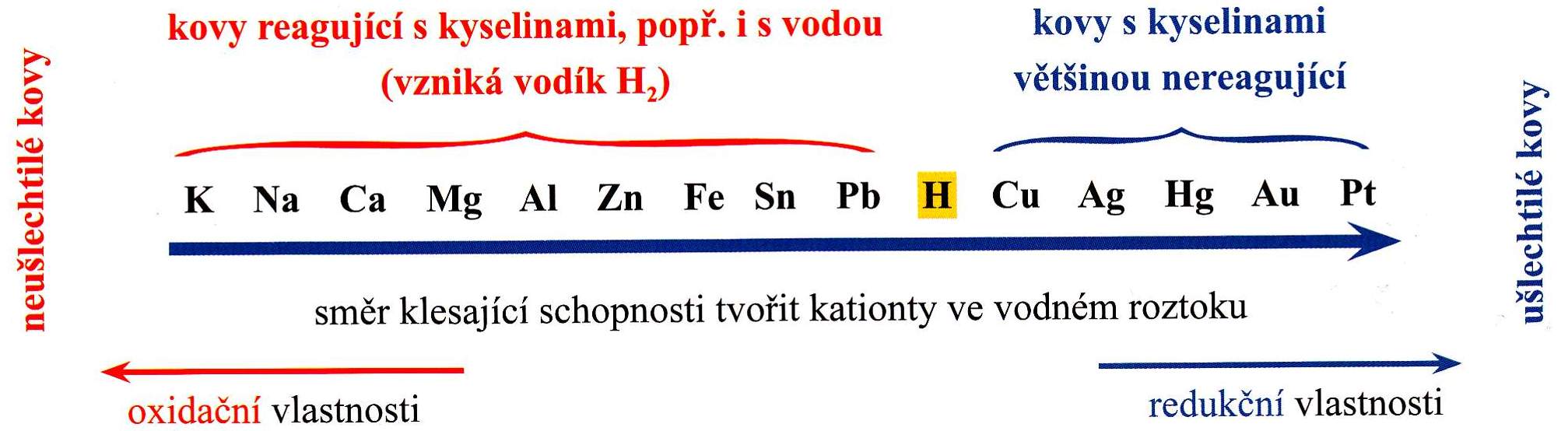
Elektrochemická řada napětí kovů
- podle míry oxidačních a redukčních schopností se kovové prvky a vodík řadí do tzv. Beketovovy řady napětí kovů (N. N. Beketov - ruský fyzikální chemik)
- neušlechtilé kovy (nalevo od vodíku) se snadno oxidují na své ionty, v přírodě pouze vázané ve sloučeninách
- ušlechtilé kovy (napravo od vodíku) se snadno redukují ze svých iontů na ryzí kovy, v přírodě ve sloučeninách i ryzí
- každý kov v Beketovově řadě napětí kovů je schopen vyredukovat všechny kovy ležící napravo od něj z jejich sloučenin, sám se přitom oxiduje
Zn + CuSO₄ → Cu + ZnSO₄ - reakce probíhá
Cu + ZnSO₄ → Zn + CuSO₄ - reakce neprobíhá
- rozdílných oxidačně-redukčních schopností kovů se využívá při elektrolytickém pokovování předmětů
Zdroj: vyuka.p3k.eu
- čím je kov více vlevo, tím snáze se oxiduje na své kationty (Ca - 2 e⁻ Ca²⁺ - snáze)
- čím je kov v řadě více vpravo, tím snáze se jeho kationty redukují na ryzí kov (Fe - 2 e⁻ Fe²⁺ - obtížněji)
Získávání kovů z rud
- kovy - většinou výskyt ve sloučeninách (rudy)
- výroba z oxidů: redukcí uhlíkem
- výroba ze sulfidů: převedení na oxid (pražení), pak redukce uhlikem
Výroba železa
- z kyslíkatých rud obsahujících oxid železitý (Fe₂O₃)
- redukcí CO a C ve vysoké peci
Vysoká pec
- shora plnění železnou rudou, koksem a vápencem
- zdola vháněn předehřátý vzduch obohacený kyslikem
- z hlušiny a vápence → struska (chrání povrch železa před oxidací)
Surové železo
- 4 % uhlíku, Si, P, S
- tvrdé, křehké
- odlévání do forem - litina (topná tělesa, části strojů)
- výroba oceli
Zkujňování železa - výroba oceli
- snižování obsahu uhlíku a dalších přimíšených prvků (Si, P)
- ocel - měkčí, kujná
- vlastnosti se dále upravují přísadou některých kovů (Cr, Ni, V, Mn, Ti)
- využívá se na výrobu nástrojů, konstrukcí, plechů, drátů, magnetů